Ionone-Béta
Naturelle - Synthétique
Floral > Floral Poudré > Floral Violette > Terreux
Crédits photo: ScenTree SAS
Autres noms :
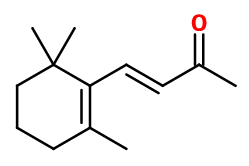
(E)-4-[(5R)-5,6,6-trimethylcyclohexen-1-yl]but-3-en-2-one ; (E)-4-(2,6,6-trimethylcyclohexen-1-yl)but-3-en-2-one
Tenue :
Coeur/Fond
Utilisation :
La Ionone-Béta est utilisée dans les reproductions de fleur de violette, dans des notes florales et fruitées (cassis, mûre). Apport d'un effet poudré et donne une image ''rétro'' aux parfums féminins. Apport d'une douceur florale. Très bon liant. A associer à la Bergamote HE, l'Hédione® et la Damascone-béta® pour un schéma ''thé''.
Présence dans la nature :
La Ionone-béta est présente dans le Cassie Absolue ou L'Osmanthus Absolue, permettant ainsi d'en extraire à l'état naturel. Dans la grande majorité des cas, c'est la Ionone-béta de synthèse qui est utilisée en parfumerie.
Découverte :
Découverte faite à partir des Irones en 1896, isolées du beurre d'iris. Les Ionones ont été découvertes par hasard, lorsqu'un laborentin ajouta de l'acide sulfurique pour laver une verrerie ayant contenu un mauvais intermédiaire à la synthèse de l'Irone.
Commentaires et anecdotes :
La Ionone-Béta est plus boisée que la Ionone-alpha, qui est plus fruitée et florale-violette. La gamma-Ionone est quant à elle assez boisée et résineuse.
La première utilisation de la Ionone-Béta en parfumerie remonte à 1893, dans Vera Violetta, par Roger et Gallet.
La première utilisation de la Ionone-Béta en parfumerie remonte à 1893, dans Vera Violetta, par Roger et Gallet.
Gamme de prix :
€€
Stabilité :
Stable en eau de toilette et en base fonctionnelle.

Crédits photo: ScenTree SAS
- Formule brute :
- C13H20O
- Masse molaire :
- 192,3 g/mol
- Densité :
- 0,945
- Point éclair :
- 129°C
- Point de fusion :
- -35°C
- Aspect :
- Liquide incolore
- Log P :
- 4
- Point d'ébullition :
- 127°C (à 16 hPa)
- Seuil de détection :
- Donnée indisponible.
Voies de synthèse :
Aujourd'hui, la synthèse des Ionones est faite à parti du Citral, par réaction avec l'acétone. La catégorie de composés alors obtenue est appelée Pseudoionone. La cyclisation des Pseudoionones en Ionones se fait en milieu acide. L'acide le plus préférable pour synthétiser la Ionone-béta est l'acide sulfurique. Le rendement de cette cyclisation est nettement au profit de cet isomère.
D'une facon générale, chaque synthèse de Ionone entraine la formation d'isomères de la molécule souhaitée. Dans le cas de la Ionone-béta, une pureté de 92% environ peut être atteinte à échelle industrielle.
Précurseurs de synthèse :
La Ionone-béta est précurseur de la synthèse de la Dihydroionone-béta et de l'Ambrinol (réaction de thermolyse).
Isoméries :
La Ionone-Béta possède plusieurs isomères. La Ionone-Alpha est obtenue lors de l'étape de cyclisation de la Pseudoionone, en utilisant l'acide phosphorique au lieu de l'acide sulfurique, en quantité catalytique. La gamma-Ionone est obtenue en utilisant le trifluorure de bore en tant que catalyseur.
Les Damascone-Alpha® et Damascone-Béta® sont des isomères de position des Ionones. Leur fonction cétone ainsi qu'un groupement méthyle sont à des endroits différents de la molécule. Leur odeur en est modifiée : les Damascone® ont une odeur de pomme cuite, et non de violette.
- N° EINECS :
- 201-224-3
- N° FEMA :
- 2595
- N° JECFA :
- 389
- N° FLAVIS :
- Donnée indisponible.
- Allergènes :
- Cet ingrédient ne contient pas d'allergènes.
- IFRA :
- Ingrédient non réglementé
Pour en savoir plus sur les standards de l'IFRA : https://ifrafragrance.org/safe-use/library
ScenTree est seul responsable des informations fournies ici.


